Ни одно принципиальное препятствие не мешает нам разработать эффективное лечение болезни Альцгеймера. Прочие неприятности человеческого характера, такие как насилие, жадность и нетерпимость, имеют удивительное разнообразие ужасных причин и неуверенности. Но, по сути, болезнь Альцгеймера - это проблема клеточной биологии, решение которой должно быть в пределах нашего досягаемости. Существует достаточно хороший шанс, что научное сообщество уже может непризнану обработку хранить в лабораторном морозильнике среди многочисленных флаконов химикатов. А основные данные теперь могут находиться в ожидании, что их заметят, в больших базах данных или реестрах клинических записей, нейропсихологических профилях, исследованиях мозга, биологических маркеров в крови и спинальной жидкости, геномах, анализе белков, записях нейронов или культуре животных и клеток моделей.
Но мы пропустили эти подсказки, потому что в течение десятилетий мы тратили слишком много времени, преследуя каждый глянцевую новую находку в исследованиях Альцгеймера, и слишком мало времени глубоко размышляя об основных биологии этого недуга. Зато наша работа была обусловлена рядом предположений. Среди этих предположений была центральная и доминирующая роль белкового фрагмента под названием бета-амилоид. Большое количество данных поддерживает мнение о том, что бета-амилоид играет важную роль в заболевании. Мы разработали препараты, которые могут снизить концентрацию белковых фрагментов у людей с болезнью на Альцгеймера, но, по большому счету, они ничем не остановили снижение когнитивного состояния пациентов.
Сейчас кажется упрощенным сделать вывод о том, что устранение или ингибирования бета-амилоида вылечит или лечит тех, кто страдает заболеваниями, особенно без более глубоких и всесторонних знаний о том, как оно развивается и прогрессирует. Мы не лаяли абсолютно неправильного дерева исследования, но наше упорство заставило нас игнорировать другие деревья и даже корни этого конкретного.
Пришло время вернуться к основам. Я был ученым, который занимался исследованиями Альцгеймера в течение трех десятилетий, частью крупных проектов исследовал семьи с высоким риском развития болезни Альцгеймера, стратегий профилактики и физиологии повреждения клеток мозга, является частью болезни. Я и мои коллеги, которые работают во многих научных и медицинских дисциплинах, считают, что нам необходимо пересмотреть фундаментальную физиологию и биологию болезни Альцгеймера, а также просматривать содержимое баз данных и наших лабораторных холодильников на предмет подсказок, которые мы, возможно, не заметили. Такой подход позволит нам разработать теории и модели того, как протекает эта болезнь, и мы можем использовать эти идеи для получения новых стратегий борьбы с болезнью.
Существует по меньшей мере пять потенциально плодотворных и своевременных направлений исследования - сферы, основанные на важных открытиях, сделанных за последние несколько лет, - которые могут расширить наши знания, и я считаю, что они, вероятно, дадут понять, необходимые для поиска эффективных методов лечения . Эти области варьируются от неисправностей в том, как клетки головного мозга избавляются от проблемных белков, повреждение, вызванного воспалением, к неприятностям со способами передачи клетками электрических сигналов друг другу. Это разные сферы, но у человека они перекрываются, чтобы создать болезни в мозге, и отдельно или в тандеме они могут лежать за ужасной вредом, причиненным Альцгеймера.

Изображение: Гален Дара
Проблемы с обезвреживанием белка
Начиная с 1900-х годов, несколько невропатологов, включая Алоиза Альцгеймера, ученого, названного болезнью, описали микроскопические поражения в головном мозге пациентов, умерших с различными формами деменции. Сегодня мы знаем, что это грудки неправильных белков. В случае болезни Альцгеймера часть скоплений состоит из кусочков бета-амилоидного белка. Они сидят между нейронами и называются старческими бляшками. Другие скопления содержатся в нейронах, изготовленные из белка, известного как тау, и называются Нейрофибриллярные комочками.
То, что мы еще не знаем, больше, чем сто лет назад, почему клетки не удается удалить эти аномальные комочки. Клеточные механизмы удаления поврежденных белков так же древние, как и сама жизнь. Что пошло не так в случае Альцгеймера? Этот вопрос настолько же центральным в заболевании, поскольку потеря контроля над пролиферацией клеток является прогрессированием рака. Некоторые последние наблюдения исследователей из Вашингтонского университета в Сент-Луисе, среди других учреждений, свидетельствуют о том, что аномальные белки могут найти выход из клеток, возможно, уклоняясь от их природных систем обнаружения плохих молекул. Мы не знаем, как они это делают, но выяснение этого может быть очень полезным способом начать новый поиск того, как и почему прогрессирует Альцгеймер.
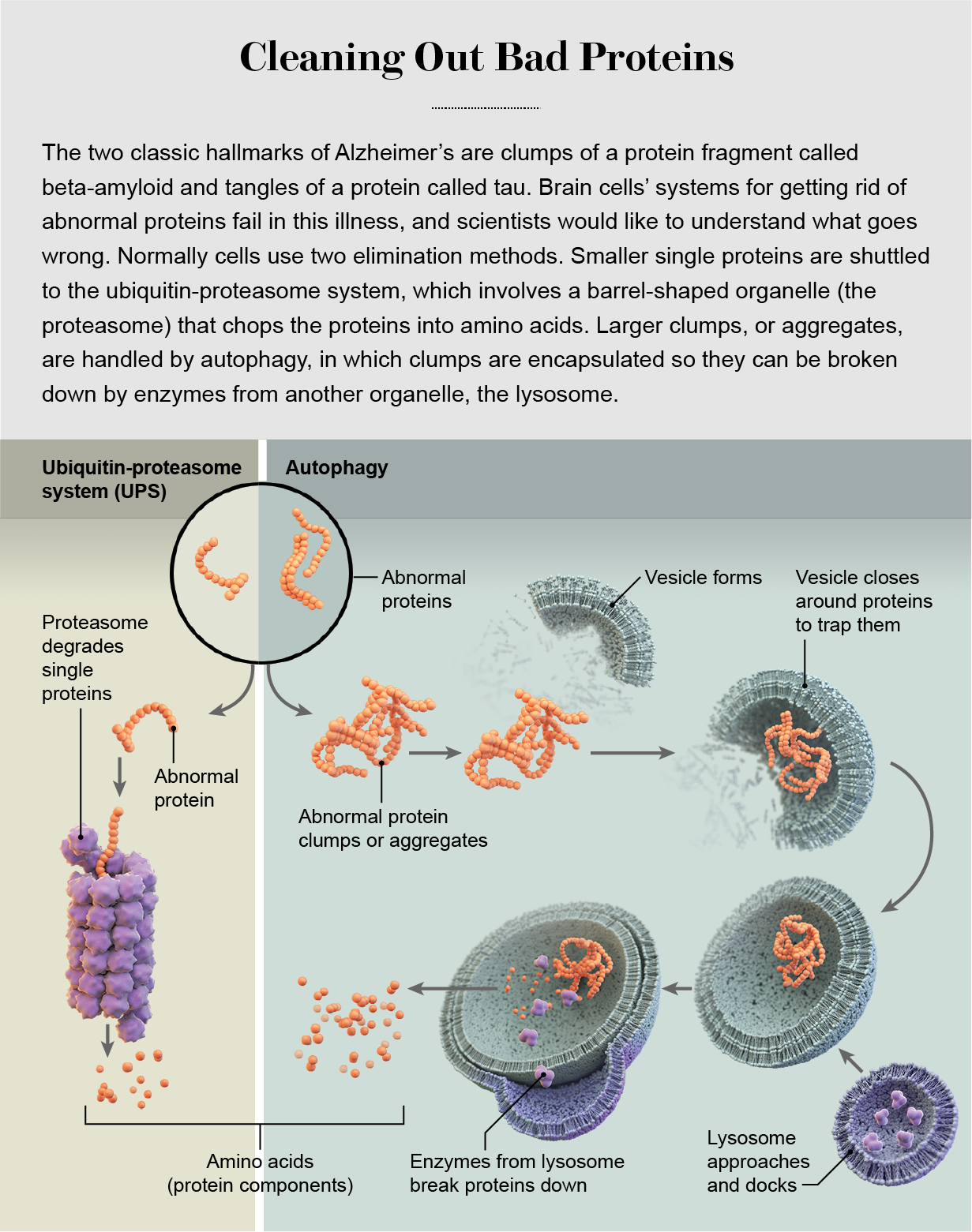
Клетки имеют две основные системы для удаления аномальных белков: система убиквитин-протеасомы (UPS) и аутофагия. В первом белки вставляют в бочкообразную структуру клеток, называется протеасомы, где они расщепляются на многократные части; в последнем клетка заворачивает аберрантных белки и полностью уничтожает их. В нейронах эти системы кооптированы для управления складом клеточных сигнальных связей - образованных анатомическими структурами, известными как аксоны, дендриты и синапсы - поскольку они усиливаются или ослабляются во время учебы. Иногда нейроны выдавливают поврежденные белки и превращают их разрушения на микроглию, клетки мозга, входящих в состав иммунной системы.
Решение о том, чтобы перенести аномальный белок в сторону ИБП или аутофагии, главным образом, основывается на размере белка. Протеасома имеет узкое, похожее на время, отверстие на каждом конце, которое может принять небольшую, тонкую, нитевидные белковую цепь. Внутри него находятся ферменты, которые расщепляют белок на составляющие аминокислоты, которые перерабатываются для использования в синтезе новых белков. Большие молекулы, которые не входят в протеасомы, такие как сгустки белков и старые, взбивают белки с повреждением возраста, попадают в систему аутофагии и ее мощного двигателя разрушения - лизосомы.
В болезни Альцгеймера то идет не так и оставляет клетки мозга с этими кусками тау и амилоида, которые еще больше повреждают или душит их. Поэтому мы могли бы узнать огромное количество о патологии болезни Альцгеймера, если бы поняли детали этих систем. Нам нужно изучить конкретные различия в путях деградации в различных подтипах нейронов, а также точный механизм, с помощью которого эти системы утилизации распознают аномальные белки. Нарушения в белках, таких как тау, не происходит за один шаг. Белки могут скрывать мутации и накапливать модификации, которые вызывают их неправильное составление, после чего может осуществляться агрегация в большие и большие структуры в многоэтапный процесс. Когда белки продвигаются на этом пути, в момент системы надзора запускают и признают их ненормальными? Углубленные знания о подобных процессы могут привести нас к более стратегического подхода к лечению и вмешательства с наркотиками.
Одним из интригующих выводов, влияет на наше понимание такого уклонения, является то, что тау может выезжать из клеток и в промежутки между ними, а оттуда его принимают соседние клетки. Какой цели служит эта транзитная система, неизвестно. Или нормальный обмен белка между клетками, или клетки выбивают ненормальное тау, чтобы избавить себя от токсического вещества? Мы считаем, что в болезни Альцгеймера по крайней мере часть белка тау вне клеток уже неправильно составлена. Мы считаем это тем, что когда такая тау попадает в соседнюю клетку, она формирует шаблон, аномальный рисунок, другие белки тау в этой клетке используют для формирования себя подобными странными способами. Когда она распространяется, тау в соседних клетках копирует специфическую форму введенного тау-белка.
Наблюдение тау над клетками побудили некоторых предполагать, что в этот момент белок может быть перехвачен и очищенный антителом, доставленным пациенту. Но такой подход вряд ли сработает, если мы точно не знаем, как тау неправильно работает, когда наносит вред. Эта точная структура является необходимой информацией для конструирования высокоспецифического антитела. Еще один открытый вопрос - где тау находится в сложном пространстве между клетками. Более конкретно, движется он через синапсы, где два нейроны передают свои сигналы? Эта синаптическая щель представляет собой узкий промежуток, который не легко доступен антител. Потенциально более перспективными подходами является понять, как тау экструдируется из клеток и рецепторов, соседние клетки используют для переборки белка.
Выявление бикових изменений
Но разрушение этих структур является сложной целью по многим причинам, не последняя из которых состоит в том, насколько сильно весь клубок держится вместе. Более успешным направлением может быть определение последовательности микроскопических событий, которые переводят эти тау-белки с их типичного ридкоподибного состояния к более жесткому и твердого состояния, наблюдается на этом изображении, и выявление модификаций белка, склоняют тау к этому изменению.
Изображение: Медицинская иллюстрация Кэмпбелла
Переход от жидкой до твердой называется фазовым переходом. Интерес биологов к таким переходам в живых клетках сейчас растет из-за их возможную роль в заболевании. Химические физики в течение многих лет изучали разделение фаз, таких как конденсация капель масла в воде. Нефть и вода - это жидкости, но они остаются отделенными через баланс привлекательных и отталкивающих сил. Преимущество разделения фаз для живых клеток заключается в том, что он концентрирует определенный набор молекул в одном месте, что способствует определенной клеточной деятельности. Например, несколько белков вблизи гена могут конденсироваться для контроля экспрессии этого гена, как показано в документе 2018 года в Science. Такой сгущенный набор белков, хотя до сих пор находится в жидком состоянии, не рассеивается; они содержатся вместе как капелька слабыми физическими силами.
Некоторые белки, например тау, плотно упаковываются, когда они расположены внутри капельки, и высокие концентрации могут сделать их склонными к агрегации в клубок. Белки, образующие капельки таким образом, имеют свойство, известное как внутреннее расстройство. Как и греческий бог Протей, они могут приобретать многочисленных форм, в отличие от более упорядоченных белков, ограниченных несколькими конкретными формами. Различные формы требуют разного уровня энергии. Порой некоторые внутренне неупорядоченные белки состоят в такой низкий энергетический состояние, они не могут выйти из него, что существенно повышает их жесткость. А это может усилить их склонность к сплетения.
Клетки также упаковывают белки и другие молекулы, подвержены фазовых переходов в безмембранных органеллы, которые называются гранулами стресса и гранатами РНК. Когда определенные белки и РНК сливаются в такие гранулы, они плотно упаковываются, но, как правило, остаются в жидком состоянии. Однако при определенной плотности они могут стать склонными к большему скопления и к изменению фазы к твердой вещества, изменения, увеличит их способность вызывать повреждения мозга и усложнит их удаления. Вот почему нам нужно лучше понять условия, которые вызывают этот процесс.
Влияние генов
У людей среднего возраста Альцгеймер может возникнуть в результате генетических мутаций в трех генах (APP, PSEN1 и PSEN2), которые вызывают редкую семейную форму заболевания, страшное подражания, что передается от одного поколения к другому. Но в подавляющем большинстве случаев болезнь Альцгеймера проявляется у людей старше 65 лет и не включает этих генов. Комбинируя десятки тысяч геномов, генетики теперь обнаружили другие изменения ДНК, около двух десятков вариантов генов, которые увеличивают риск на небольшое количество. Наиболее влиятельной из этих альтернативных форм является версия гена APOEвидомий как вариант e4. Сочетание нескольких вариантов гена риска увеличивает вероятность заболевания.Поскольку варианты генов часто ассоциируются с этнической принадлежностью, нам нужен гораздо более инклюзивный набор данных, чем анализы и реестры генов, базирующихся в основном на Кавказе, на данный момент для надежной оценки генетического риска во всех популяциях.
Каждый из этих вариантов открывает разные двери, с помощью которых мы можем исследовать пути, небольшое изменение наших геномов может увеличить нашу вероятность приобретения болезни Альцгеймера. Некоторые из наиболее часто встречающихся вариантов, и, следовательно, самые интересные двери - это гены или другие участки ДНК в микроглии. В научном документе на 2019, изучавший эти клетки иммунной системы, ученые нашли один вариант, связанный с риском Альцгеймера, в гене, известном как BIN1. Этот ген, как правило, участвует в том, как микроглия поглощает потенциально вредные внешние молекулы и перемещает их в клетку, защищая расположены рядом нейроны. Вариант может влиять на то, насколько эффективно микроглия очищает блуждающие белки.
В микроглии и других клетках определенные варианты генов также связаны с возрастом и полом. Существуют различия между мужчинами и женщинами, например, для генов на 22 парах несексуальных хромосом и генов, выраженных на Х и Y хромосомах. Эффекты этих вариантов могут быть связаны с более высокими показателями развития болезни Альцгеймера у женщин, даже корректируют продолжительность жизни женщины. В общем, небольшие эффекты любого варианта гена, ассоциированного с болезнью Альцгеймера, вероятно, способствуют, каждый по-своему ограниченным образом, индивидуальным различиям в способе обработки амилоидных и тау-скоплений. Нам нужно определить, как и почему эти взносы.
Укрощение заполнения
Когда мозг обнаруживает источник повреждения, например, амилоидные бляшки или тау нейрофибриллярни мути, он звучит настороженно и высвобождает целый ряд молекул иммунной системы под названием цитокины вместе с различными клетками атаки. Эта реакция в значительной степени следует из микроглии, и она вызывает воспалительную реакцию, которая призвана уничтожить любую ткань, препятствует возникновению проблемных мест. Эта грубая «врожденная» система действует совсем иначе, чем более усовершенствованная «адаптивная» иммунная система, которая генерирует иммунные клетки и антитела, реагирующие только на конкретных захватчиков, таких как бактерии или вирусы, и устанавливают более узкую, точную оборону. Более широкая врожденная реакция доминирует в болезни Альцгеймера. Поскольку поражения распространяются невозможным внутреннего механизма нейрона избавляться от детрита, эта общая воспалительная реакция начинается и, к сожалению, часто попадает в еще здоровых клеток в мозг. Недавно ученые Калифорнийского университета в Ирвине обнаружили, что устранение старели микроглии в старых мышей побудило животных переселять их мозги свежей микроглией. Это омоложения улучшило пространственную память, изменило возрастные изменения в экспрессии генов нейронов и увеличило рождения новых нейронов, а также плотность их дендритов.
Это нападение, инициированный амилоидом и тау, вероятно, происходит благодаря низкому уровню заполнения в мозге, которое происходит естественным образом со старением. Во многих пожилых людей повышенная концентрация провоспалительных цитокинов, таких как фактор некроза опухоли (ФНО), что позволяет предположить, что в этот момент жизни в организме существует незначительный воспалительный состояние. Старение очень изменчиво среди людей, и различия означают, что прогресс и последствия болезни Альцгеймера также довольно изменчивы. Некоторые из этого многообразия, вероятно, можно отнести к индивидуальным изменений иммунной системы человека. Разные люди наследуют различную конфигурацию генов, участвующих в иммунном ответе. Кроме того, во время нашей жизни наши системы формируются непригодными воздействиями. Мы получаем различное влияние на симбиотические бактерии в таких местах, как наша кишка и патогенные микробы из нашего окружения. Это все говорит о том, что влияние иммунной системы на различные патогены, а также наши генетические различия могут способствовать тому, как развивается Альцгеймер путем установления индивидуального иммунного профиля, или "имунотипу".
Задача для исследователей, которые хотят остановить повреждения мозга, вызванные широко распространенным воспалением, заключается в том, чтобы отличить желаемое иммунную реакцию, которую мозг использует для борьбы с проблемами развивающихся и обычной деградацией, вызванной возрастом, от других, более опрометчивых иммунных ответов прогрессирующей патологии Альцгеймера. Исследовательская сообщество хотела бы приручить воспаление мозга, вызванное болезнью, но еще не знает, как точно вмешаться.
Электрические отключения
Мозг является электрическим органом: его наиболее определяющей особенностью является способность кодировать и передавать информацию в виде электрических сигналов, передаваемых между нейронами, как правило, химикатами, которые называются нейротрансмиттерами. То, как Альцгеймер ухудшает сигнализацию клеток мозга и нарушает способ их сбора в функциональные схемы памяти, недостаточно изучен. Но теперь способность проявлять как структурные, так и функциональные связи растет благодаря техническим достижениям, которые позволяют нам визуализировать эти связи в изысканных деталях.
Некоторые из этих достижений предусматривают оптогенетики, способ ученых стимулировать специфические нейроны в мозге животного с помощью света. Исследователи могут предложить животному вознаграждение или устрашающий опыт, а потом обнаружить, какие гены становятся активными. Этот подход, впечатляющим достижением, теперь позволяет исследователям наблюдать и манипулировать конкретными нейронами, кодирующих конкретную память, известную как энграмма, как отмечалось в документе 2020 году в Science. Когда эти клетки были стимулированы только светом после первичного опыта, память о нем была отозвана. Если мы сможем разобраться в биологии, которая способствует формированию этих соединений электрической памяти, эта информация будет решающей для того, чтобы нам понять, как патология Альцгеймера прерывает эту нервную схему.

Изображение: Гален Дара
В этом году нейрознавци сделали еще один прогресс, когда обнаружили, что микроглия, кажется, принимает участие в вынуждены мозга забыть эти программы, устранив синапсы, которые обычно соединяют нейроны.
Мы также знаем, что на нейромедиаторы по-разному влияют некоторые белки, участвующие в патологии Альцгеймера. Например, Тау накапливается в нейронах, использующих нейромедиатор глутамат и работают на возбуждение сигналов. Но другие нейроны, тормозящие сигналы - сигнализация возлагается на хорошие механизмы запуска и остановки - высвобождают другой нейротрансмиттер, GABA, и меньше влияют на накопление тау. Основа этой клеточной избирательности и ее последствия неизвестны, и нам нужно понять ее гораздо лучше. Ученые также увидели, что активность нейронов усиливает распространение тау, что может стать еще одной важной частью загадки Альцгеймера.
Мало того, что типы сигнальных клеток по-разному влияют на процесс заболевания, но эффекты различаются и в разных областях мозга. Например, участки мозга, связанные с памятью, эмоциями и сном, сильно повреждены, тогда как центры, связанные с первичной двигательной и сенсорной функцией, относительно повреждены. Одно исследование показало, что участки мозга, которые активируются, когда наш ум блуждает, так называемое состояние дефолта или покоя, - это те самые места, где впервые оседают амилоидные бляшки. Но мы должны быть осторожными в осуществлении выводов - блуждающий ум не обязательно вызывает отложение амилоида.
Сон - это еще один электрический состояние мозга, который все чаще признается фактором развития болезни Альцгеймера. Уровне амилоида и тау колеблются во время нормального цикла сна-бодрствования, а недосыпание остро увеличивает выработку амилоида и уменьшает его клиренс. Глубокий сон вызывает ритмичные волны спинномозговой жидкости, которые могут служить для выведения токсинов, включая амилоид, из мозга. К сожалению, такой вид сна уменьшается со старением. Это наблюдение могло бы стимулировать работу над фармакологическими подходами, разработанными специально для восстановления глубокого сна.
Общие идеи
Эти исследовательские области не является всесторонним и не законченным омоложенной научной программой Альцгеймера. Конечно, есть и более. Но эти пять путей переплетаются, как и сама биология, могут быть исследованы многими способами перекрестного оплодотворения. Я надеюсь, что в качестве основной наука заполняет пропущенную информацию - особенно количественную информацию - вычислительные Моделер и теоретики вступят, чтобы помочь предсказать влияние патологии Альцгеймера на мозговые схемы и клеточные пути. Я также хотел бы, чтобы эти направления исследований побудили исследователей к коллективной и систематического мышления и обмена своими идеями конструктивно. Вот как мы можем собраться, чтобы оттолкнуть свое невежество об этой страшной болезни.
Перевод текста "Five Types of Research, Underexplored until Recently, Could Produce Alzheimer's Treatments" с научно-популярного журнала "Scientific American".








