Жодна принципова перешкода не заважає нам розробити ефективне лікування хвороби Альцгеймера. Інші неприємності людського характеру, такі як насильство, жадібність та нетерпимість, мають дивовижну різноманітність жахливих причин та непевності. Але, по суті, хвороба Альцгеймера - це проблема клітинної біології, розв’язання якої має бути в межах нашого досяжності. Існує досить хороший шанс, що наукове співтовариство вже може непризнану обробку зберігати в лабораторному морозильнику серед численних флаконів хімікатів. А основні дані тепер можуть знаходитись, чекаючи, що їх помітять, у великих базах даних або реєстрах клінічних записів, нейропсихологічних профілях, дослідженнях мозку, біологічних маркерів у крові та спинальній рідині, геномах, аналізі білків, записах нейронів або культурі тварин та клітин моделей.
Але ми пропустили ці підказки, тому що протягом десятиліть ми витрачали занадто багато часу, переслідуючи кожну глянсову нову знахідку в дослідженнях Альцгеймера, і занадто мало часу глибоко розмірковуючи про основні біології цієї недуги. Натомість наша робота була зумовлена низкою припущень. Серед цих припущень була центральна і домінуюча роль білкового фрагмента під назвою бета-амілоїд. Велика кількість даних підтримує думку про те, що бета-амілоїд відіграє важливу роль у захворюванні. Ми розробили препарати, які можуть знизити концентрацію білкових фрагментів у людей з хворобою на Альцгеймера, але, за великим рахунком, вони нічим не зупинили зниження когнітивного стану пацієнтів.
Зараз здається спрощеним зробити висновок про те, що усунення або інгібування бета-амілоїду вилікує або лікує тих, хто страждає на захворювання, особливо без більш глибоких та всебічних знань про те, як воно розвивається та прогресує. Ми не гавкали абсолютно неправильного дерева дослідження, але наше завзяття змусило нас ігнорувати інші дерева і навіть коріння цього конкретного.
Настав час повернутися до основ. Я був вченим, який займався дослідженнями Альцгеймера протягом трьох десятиліть, частиною великих проектів досліджував сім'ї з високим ризиком розвитку хвороби Альцгеймера, стратегій профілактики та фізіології пошкодження клітин мозку, що є частиною хвороби. Я та мої колеги, які працюють у багатьох наукових та медичних дисциплінах, вважають, що нам необхідно переглянути фундаментальну фізіологію та біологію хвороби Альцгеймера, а також переглядати вміст баз даних та наших лабораторних холодильників на предмет підказок, які ми, можливо, не помітили. Такий підхід дозволить нам розробити теорії та моделі того, як протікає ця хвороба, і ми можемо використовувати ці ідеї для отримання нових стратегій боротьби з хворобою.
Існує щонайменше п’ять потенційно плідних та своєчасних напрямків дослідження - сфери, засновані на важливих відкриттях, зроблених за останні кілька років, - які можуть розширити наші знання, і я вважаю, що вони, ймовірно, дадуть зрозуміти, необхідні для пошуку ефективних методів лікування. Ці області варіюються від несправностей у тому, як клітини головного мозку позбавляються від проблемних білків, до пошкодження, спричиненого запаленням, до неприємностей зі способами передачі клітинами електричних сигналів один одному. Це різні сфери, але у людини вони перекриваються, щоб створити хвороби в мозку, і окремо або в тандемі вони можуть лежати за жахливою шкодою, завданою Альцгеймером.

Зображення: Гален Дара
Проблеми з знешкодженням білка
Починаючи з початку 1900-х років, кілька невропатологів, включаючи Алоїза Альцгеймера, вченого, названого хворобою, описали мікроскопічні ураження в головному мозку пацієнтів, які померли з різними формами деменції. Сьогодні ми знаємо, що це грудки неправильних білків. У випадку хвороби Альцгеймера частина скупчень складається з шматочків бета-амілоїдного білка. Вони сидять між нейронами і називаються старечими бляшками. Інші скупчення містяться в нейронах, виготовлені з білка, відомого як тау, і називаються нейрофібрилярними клубочками.
Те, що ми ще не знаємо, більше, ніж століття тому, чому клітини не вдається видалити ці аномальні грудочки. Клітинні механізми видалення пошкоджених білків так само давні, як і саме життя. Що пішло не так у випадку Альцгеймера? Це питання є настільки ж центральним у захворюванні, оскільки втрата контролю над проліферацією клітин є прогресуванням раку. Деякі останні спостереження дослідників з Вашингтонського університету в Сент-Луїсі, серед інших установ, свідчать про те, що аномальні білки можуть знайти вихід із клітин, можливо, ухиляючись від їх природних систем виявлення поганих молекул. Ми не знаємо, як вони це роблять, але з'ясування цього може бути дуже корисним способом почати новий пошук того, як і чому прогресує Альцгеймер.
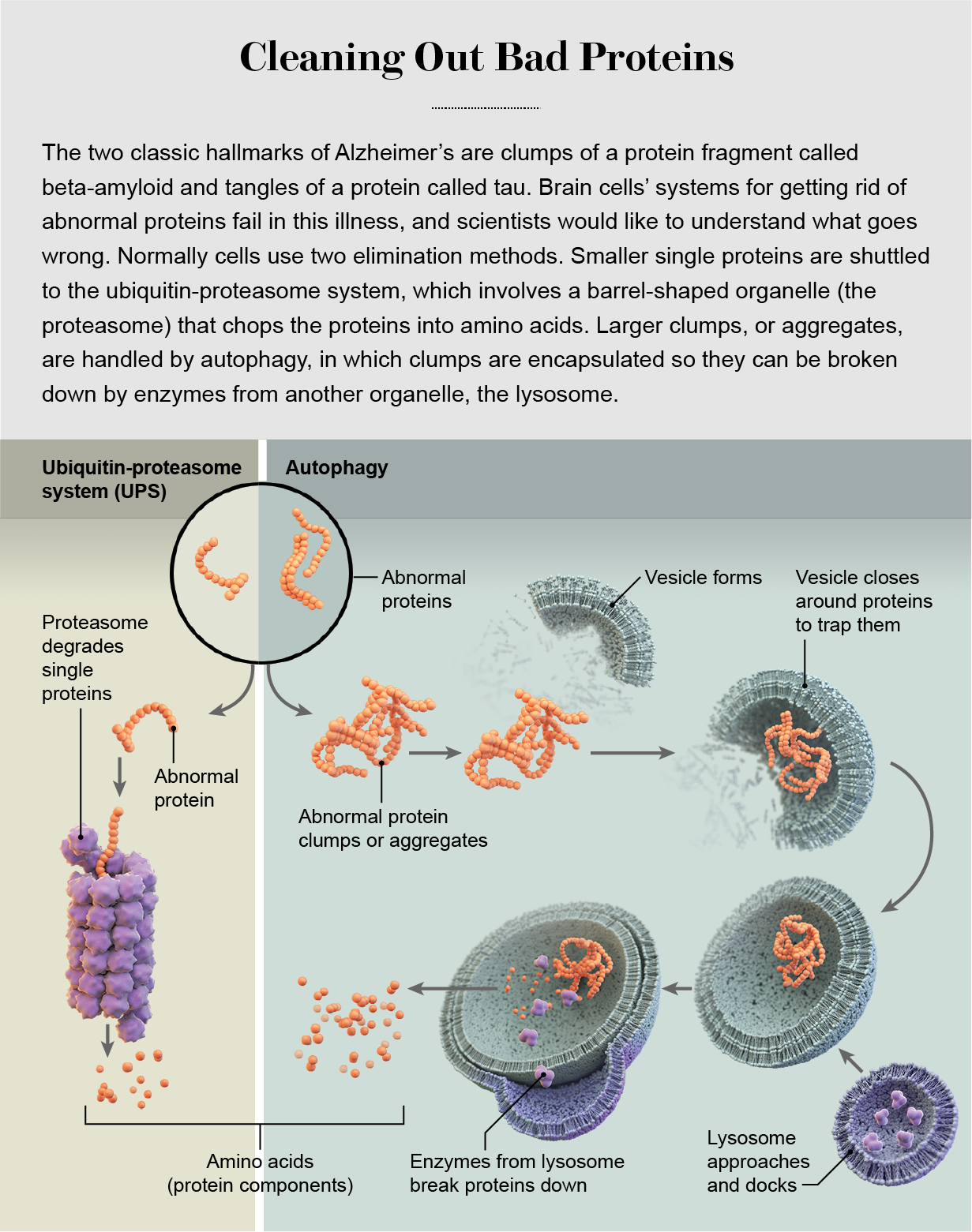
Клітини мають дві основні системи для видалення аномальних білків: система убиквітин-протеасоми (UPS) та аутофагія. У першому білки вставляють у бочкоподібну структуру клітин, що називається протеасомою, де вони розщеплюються на багаторазові частини; в останньому клітина загортає аберрантні білки і повністю знищує їх. У нейронах ці системи кооптовані для управління складом клітинних сигнальних зв’язків - утворених анатомічними структурами, відомими як аксони, дендрити та синапси - оскільки вони підсилюються або послаблюються під час навчання. Іноді нейрони видавлюють пошкоджені білки і перетворюють їх руйнування на мікроглію, клітини мозку, що входять до складу імунної системи.
Рішення про те, щоб перенести аномальний протеїн у бік ДБЖ або аутофагії, головним чином, ґрунтується на розмірі білка. Протеасома має вузьке, схоже на пори, отвір на кожному кінці, яке може прийняти невелику, тонку, ниткоподібну білкову ланцюг. Всередині нього знаходяться ферменти, які розщеплюють білок на складові амінокислоти, які переробляються для використання в синтезі нових білків. Більші молекули, які не входять до протеасоми, такі як згустки білків та старі, збивають білки з пошкодженням віку, потрапляють до системи аутофагії та її потужнішого двигуна руйнування - лізосоми.
У хвороби Альцгеймера щось йде не так і залишає клітини мозку з цими шматками тау і амілоїду, які ще більше пошкоджують або задушують їх. Тож ми могли б дізнатися величезну кількість про патологію хвороби Альцгеймера, якби зрозуміли деталі цих систем. Нам потрібно вивчити конкретні відмінності в шляхах деградації в різних підтипах нейронів, а також точний механізм, за допомогою якого ці системи утилізації розпізнають аномальні білки. Порушення в білках, таких як тау, не відбувається за один крок. Білки можуть приховувати мутації та накопичувати модифікації, що спричиняють їх неправильне складання, після чого може здійснюватися агрегація у більші та більші структури в багатоетапному процесі. Коли білки просуваються на цьому шляху, в який момент системи нагляду запускають і визнають їх ненормальними? Поглиблені знання про подібні процеси можуть привести нас до більш стратегічного підходу до лікування та втручання з наркотиками.
Одним із інтригуючих висновків, що впливає на наше розуміння такого ухилення, є те, що тау може виїжджати з клітин і в проміжки між ними, а звідти його приймають сусідні клітини. Якій цілі служить ця транзитна система, невідомо. Чи нормальний обмін білка між клітинами, чи клітини вибивають ненормальне тау, щоб позбавити себе від токсичної речовини? Ми вважаємо, що у хвороби Альцгеймера принаймні частина білка тау поза клітинами вже неправильно складена. Ми вважаємо це тим, що коли така тау потрапляє в сусідню клітину, вона формує шаблон, аномальний малюнок, який інші білки тау в цій клітині використовують для формування себе подібними дивними способами. Коли вона поширюється, тау в сусідніх клітинах копіює специфічну форму введеного тау-білка.
Спостереження тау над клітинами спонукали деяких припускати, що в цей момент білок може бути перехоплений та очищений антитілом, доставленим пацієнту. Але такий підхід навряд чи спрацює, якщо ми точно не знаємо, як тау неправильно працює, коли завдає шкоди. Ця точна структура є необхідною інформацією для конструювання високоспецифічного антитіла. Ще одне відкрите питання - де тау знаходиться у складному просторі між клітинами. Більш конкретно, чи рухається він через синапси, де два нейрони передають свої сигнали? Ця синаптична щілина являє собою вузький проміжок, який не легко доступний антитілу. Потенційно більш перспективними підходами є зрозуміти, як саме тау екструдується з клітин та рецепторів, які сусідні клітини використовують для перебирання білка.
Виявлення бікових змін
Але руйнування цих структур є складною метою з багатьох причин, не остання з яких полягає в тому, наскільки сильно весь клубок тримається разом. Більш успішним напрямком може бути визначення послідовності мікроскопічних подій, які переводять ці тау-білки з їх типового рідкоподібного стану до більш жорсткого і твердого стану, що спостерігається на цьому зображенні, та виявлення модифікацій білка, що схиляють тау до цієї зміни.
Зображення: Медична ілюстрація Кемпбелла
Перехід від рідкої до твердої називається фазовим переходом. Інтерес біологів до таких переходів у живих клітинах зараз зростає через їх можливу роль у захворюванні. Хімічні фізики протягом багатьох років вивчали поділ фаз, таких як конденсація крапель олії у воді. Нафта і вода - це рідини, але вони залишаються відокремленими через баланс привабливих та відштовхуючих сил. Перевага поділу фаз для живих клітин полягає в тому, що він концентрує певний набір молекул в одному місці, що сприяє певній клітинній діяльності. Наприклад, кілька білків поблизу гена можуть конденсуватися для контролю експресії цього гена, як показано в документі 2018 року в Science. Такий згущений набір білків, хоча і досі знаходиться в рідкому стані, не розсіюється; вони утримуються разом як крапелька слабкими фізичними силами. Ця конфігурація дозволяє наборам білків рухатися і працювати разом, не загортаючись в мембрану, що вимагає витрат на обслуговування ресурсів у клітині.
Деякі білки, наприклад тау, щільно упаковуються, коли вони розташовані всередині крапельки, і високі концентрації можуть зробити їх схильними до агрегації в клубок. Білки, що утворюють крапельки таким чином, мають властивість, відому як внутрішнє розлад. Як і грецький бог Протей, вони можуть набувати численних форм, на відміну від більш упорядкованих білків, обмежених кількома конкретними формами. Різні форми вимагають різного рівня енергії. Часом деякі внутрішньо невпорядковані білки складаються в такий низький енергетичний стан, що вони не можуть вийти з нього, що суттєво підвищує їх жорсткість. А це може посилити їх схильність до сплетення.
Клітини також упаковують білки та інші молекули, схильні до фазових переходів у безмембранні органели, які називаються гранулами стресу та гранатами РНК. Коли певні білки та РНК зливаються в такі гранули, вони щільно упаковуються, але, як правило, залишаються в рідкому стані. Однак при певній щільності вони можуть стати схильними до більшого скупчення та до зміни фази до твердої речовини, зміни, що збільшить їх здатність спричиняти пошкодження мозку та ускладнить їх видалення. Ось чому нам потрібно краще зрозуміти умови, які викликають цей процес.
Вплив генів
У людей середнього віку Альцгеймер може виникнути внаслідок генетичних мутацій у трьох генах ( APP, PSEN1 та PSEN2 ), які викликають рідкісну сімейну форму захворювання, страшне наслідування, що передається від одного покоління до іншого. Але в переважній більшості випадків хвороба Альцгеймера виявляється у людей старше 65 років і не включає цих генів. Комбінуючи десятки тисяч геномів, генетики тепер виявили інші зміни ДНК, приблизно два десятки варіантів генів, які збільшують ризик на невелику кількість. Найбільш впливовою з цих альтернативних форм є версія гена APOEвідомий як варіант e4. Поєднання декількох варіантів гена ризику збільшує ймовірність захворювання. Оскільки варіанти генів часто асоціюються з етнічною приналежністю, нам потрібен набагато більш інклюзивний набір даних, ніж аналізи та реєстри генів, що базуються в основному на Кавказі, на даний момент для надійної оцінки генетичного ризику у всіх популяціях.
Кожен із цих варіантів відкриває різні двері, за допомогою яких ми можемо дослідити шляхи, що невелика зміна наших геномів може збільшити нашу ймовірність придбання хвороби Альцгеймера. Деякі з найбільш часто зустрічаються варіантів, і, отже, найцікавіші двері - це гени або інші ділянки ДНК в мікроглії. У науковому документі на 2019 рік, що вивчав ці клітини імунної системи, вчені знайшли один варіант, пов'язаний з ризиком Альцгеймера, в гені, відомому як BIN1 . Цей ген, як правило, бере участь у тому, як мікроглія поглинає потенційно шкідливі зовнішні молекули та переміщує їх у клітину, захищаючи розташовані поруч нейрони. Варіант може впливати на те, наскільки ефективно мікроглія очищає блукаючі білки.
У мікроглії та інших клітинах певні варіанти генів також пов'язані з віком і статтю. Існують відмінності між чоловіками та жінками, наприклад, для генів на 22 парах несексуальних хромосом та генів, виражених на Х та Y хромосомах. Ефекти цих варіантів можуть бути пов'язані з більш високими показниками розвитку хвороби Альцгеймера у жінок, які навіть коригують тривалість життя жінки. Загалом, невеликі ефекти будь-якого варіанта гена, асоційованого з хворобою Альцгеймера, ймовірно, сприяють, кожен по-своєму обмеженим чином, індивідуальним відмінностям у способі обробки амілоїдних та тау-скупчень. Нам потрібно визначити, як і чому ці внески.
Приборкання запалення
Коли мозок виявляє джерело пошкодження, наприклад, амілоїдні бляшки або тау нейрофібриллярні каламути, він звучить насторожено і вивільняє цілий ряд молекул імунної системи під назвою цитокіни разом з різними клітинами атаки. Ця реакція в значній мірі випливає з мікроглії, і вона викликає запальну реакцію, яка покликана знищити будь-яку тканину, що перешкоджає виникненню проблемних місць. Ця груба «вроджена» система діє зовсім інакше, ніж більш вдосконалена «адаптивна» імунна система, яка генерує імунні клітини та антитіла, що реагують лише на конкретних загарбників, таких як бактерії чи віруси, і встановлюють більш вузьку, точну оборону. Більш широка вроджена реакція домінує у хвороби Альцгеймера. Оскільки ураження поширюються поза можливостями внутрішнього механізму нейрона позбавлятися від детриту, ця загальна запальна реакція починається і, на жаль, часто потрапляє до ще здорових клітин у мозок. Нещодавно вчені Каліфорнійського університету в Ірвіні виявили, що усунення старілої мікроглії у старих мишей спонукало тварин переселяти їх мізки свіжою мікроглією. Це омолодження поліпшило просторову пам’ять, змінило вікові зміни в експресії генів нейронів і збільшило народження нових нейронів, а також щільність їх дендритів.
Цей напад, ініційований амілоїдом і тау, ймовірно, відбувається завдяки низькому рівню запалення в мозку, яке відбувається природним чином зі старінням. У багатьох літніх людей підвищена концентрація прозапальних цитокінів, таких як фактор некрозу пухлини (ФНП), що дозволяє припустити, що в цей момент життя в організмі існує незначний запальний стан. Старіння дуже мінливе серед людей, і відмінності означають, що прогрес і наслідки хвороби Альцгеймера також досить мінливі. Деякі з цього різноманіття, ймовірно, можна віднести до індивідуальних змін імунної системи людини. Різні люди успадковують різну конфігурацію генів, що беруть участь в імунній відповіді. Крім того, під час нашого життя наші системи формуються непридатними впливами. Ми отримуємо різний вплив на симбіотичні мікроби в таких місцях, як наша кишка та патогенні мікроби з нашого оточення. Це все говорить про те, що вплив імунної системи на різні патогени, а також наші генетичні відмінності можуть сприяти тому, як розвивається Альцгеймер шляхом встановлення індивідуального імунного профілю, або "імунотипу".
Завдання для дослідників, які хочуть зупинити пошкодження мозку, спричинені широко розповсюдженим запаленням, полягає в тому, щоб відрізнити бажану імунну реакцію, яку мозок використовує для боротьби з проблемами, що розвиваються, і звичайною деградацією, спричиненою віком, від інших, більш необачних імунних відповідей на прогресуючу патологію Альцгеймера. Дослідницька спільнота хотіла б приручити запалення мозку, викликане хворобою, але ще не знає, як точно втрутитися.
Електричні відключення
Мозок є електричним органом: його найбільш визначальною особливістю є здатність кодувати та передавати інформацію у вигляді електричних сигналів, що передаються між нейронами, як правило, хімікатами, які називаються нейротрансмітерами. Те, як Альцгеймер погіршує сигналізацію клітин мозку та порушує спосіб їх збирання у функціональні схеми пам'яті, недостатньо вивчений. Але тепер здатність виявляти як структурні, так і функціональні зв'язки зростає завдяки технічним досягненням, які дозволяють нам візуалізувати ці зв’язки у вишуканих деталях.
Деякі з цих досягнень передбачають оптогенетику, спосіб вчених стимулювати специфічні нейрони в мозку тварини за допомогою світла. Дослідники можуть запропонувати тварині винагороду чи страхітливий досвід, а потім виявити, які гени стають активнішими. Цей підхід, вражаючим досягненням, тепер дозволяє дослідникам спостерігати та маніпулювати конкретними нейронами, що кодують конкретну пам’ять, відому як енграма, як зазначалося в документі 2020 року в Science . Коли ці клітини були стимульовані лише світлом після первинного досвіду, пам'ять про нього була відкликана. Якщо ми зможемо розібратися в біології, яка сприяє формуванню цих з'єднань електричної пам'яті, ця інформація буде вирішальною для того, щоб нам зрозуміти, як патологія Альцгеймера перериває цю нервову схему.

Зображення: Гален Дара
Цього року нейрознавці зробили ще один прогрес, коли виявили, що мікроглія, здається, бере участь у змушенні мозку забути ці програми, усунувши синапси, які зазвичай з'єднують нейрони.
Ми також знаємо, що на нейромедіатори по-різному впливають деякі білки, що беруть участь у патології Альцгеймера. Наприклад, Тау накопичується в нейронах, які використовують нейромедіатор глутамат і працюють на збудження сигналів. Але інші нейрони, що гальмують сигнали - сигналізація покладається на хороші механізми запуску і зупинки - вивільняють інший нейротрансмітер, GABA, і менше впливають на накопичення тау. Основа цієї клітинної вибірковості та її наслідки невідомі, і нам потрібно зрозуміти її набагато краще. Вчені також побачили, що активність нейронів посилює поширення тау, що може стати ще однією важливою частиною загадки Альцгеймера.
Мало того, що типи сигнальних клітин по-різному впливають на процес захворювання, але ефекти різняться і в різних областях мозку. Наприклад, ділянки мозку, пов’язані з пам’яттю, емоціями та сном, сильно пошкоджені, тоді як центри, пов’язані з первинною руховою та сенсорною функцією, відносно пошкоджені. Одне дослідження показало, що ділянки мозку, що активуються, коли наш розум блукає, так званий стан дефолту або спокою, - це ті самі місця, де вперше осідають амілоїдні бляшки. Але ми повинні бути обережними у здійсненні висновків - блукаючий розум не обов'язково викликає відкладення амілоїдів.
Сон - це ще один електричний стан мозку, який все частіше визнається фактором розвитку хвороби Альцгеймера. Рівні амілоїду та тау коливаються під час нормального циклу сну-неспання, а недосипання гостро збільшує вироблення амілоїду та зменшує його кліренс. Глибокий сон викликає ритмічні хвилі спинномозкової рідини, які можуть служити для виведення токсинів, включаючи амілоїд, з мозку. На жаль, такий вид сну зменшується зі старінням. Це спостереження могло б стимулювати роботу над фармакологічними підходами, розробленими спеціально для відновлення глибокого сну.
Спільні ідеї
Ці дослідницькі області не є всебічним і не закінченим омолодженою науковою програмою Альцгеймера. Звичайно, є і більше. Але ці п’ять шляхів переплітаються і, як і сама біологія, можуть бути досліджені багатьма способами перехресного запліднення. Я маю надію, що як основна наука заповнює пропущену інформацію - особливо кількісну інформацію - обчислювальні моделери та теоретики вступлять, щоб допомогти передбачити вплив патології Альцгеймера на мозкові схеми та клітинні шляхи. Я також хотів би, щоб ці напрямки досліджень спонукали дослідників до колективного та систематичного мислення та обміну своїми ідеями конструктивно. Ось як ми можемо зібратися, щоб відштовхнути своє невігластво про цю страшну хворобу.
Переклад тексту "Five Types of Research, Underexplored until Recently, Could Produce Alzheimer’s Treatments" з науково-популярного журналу "Scientific American".








